Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Метод полимеразной цепной реакции был открыт почти тридцать лет назад американским учёным по имени Кэрри Мюллис. Методика широко распространена в медицине в качестве диагностического инструмента, и суть её состоит в копировании участка ДНК при помощи специального фермента (полимеразы) искусственным путём в пробирке.
В каких областях медицины применяется этот метод?
Для чего выполняется копирование ДНК и как это может послужить медицине?
Данная методика позволяет:
- Выделять и клонировать гены.
- Диагностировать генетические и инфекционные заболевания.
- Определять отцовство. Ребенок частично наследует от своих биологических родителей генетические особенности, однако имеет при этом свою собственную уникальную генетическую идентификацию. Наличие у него некоторых генов, идентичных родительским генам – позволяет говорить об установлении родства.
Полимеразная цепная реакция применяется также в криминалистической практике.
На месте преступления судмедэксперты собирают образцы генетических материалов. К ним относятся: волосы, слюна, кровь. Впоследствии, благодаря методике полимеразной реакции, можно амплифицировать ДНК и сравнить идентичность взятой пробы с генетическим материалом подозреваемого человека.
В медицине эффективно используется полимеразная цепная реакция:
- В пульмонологической практике – для дифференциации бактериальных и вирусных видов пневмонии, туберкулёза.
- В гинекологической и урологической практике – для определения уреаплазмоза, хламидиоза, микоплазменной инфекции, гарднереллеза, герпеса, гонореи.
- В гастроэнтерологической практике.
- В гематологии – для определения онковирусов и цитомегаловирусной инфекции.
- В экспресс-диагностике таких инфекционных заболеваний как вирусные гепатиты, дифтерия, сальмонеллёз.
В настоящее время наиболее распространен данный метод в диагностике инфекционных болезней (гепатитов вирусной этиологии, ВИЧ, венерических заболеваний, туберкулёза, клещевого энцефалита).
Что происходит во время протекания реакции?
 Сама реакция является химически несложной. Источником ДНК для реакции может послужить капля крови, волос, кусочек кожи, и т.д. В теории, для проведения реакции требуются нужные реагенты, пробирка, проба из биологического материала и источник тепла.
Сама реакция является химически несложной. Источником ДНК для реакции может послужить капля крови, волос, кусочек кожи, и т.д. В теории, для проведения реакции требуются нужные реагенты, пробирка, проба из биологического материала и источник тепла.
Полимеразная реакция позволяет выявить инфекцию, даже если в пробе с биологическим материалом находится всего одна или несколько ДНК-молекул возбудителя.
Во время протекания реакции, благодаря ферменту ДНК-полимеразы, происходит удвоение (репликация) участка ДНК. Сама же дезоксирибонуклеиновая кислота (сокращенно ДНК) важна для нас тем, что обеспечивает хранение и передачу дочерним клеткам генетической информации. ДНК имеет вид спирали, которая состоит из повторяющихся блоков. Эти блоки составляют нуклеотиды, которые являются наименьшей частицей ДНК. Нуклеотиды образуются из аминокислот.
Процесс репликации участков ДНК происходит во время повторяющихся циклов. В каждый такой цикл копируется и удваивается не только исходный фрагмент ДНК, но и те фрагменты, которые уже удвоились в прошлый цикл амплификации. Все это напоминает процесс геометрической прогрессии.
Существует:
- Естественная амплификация (то есть процесс копирования и размножения ДНК), которая происходит в нашем организме и является детерминированным, предопределённым процессом.
- Искусственная амплификация, которая происходит благодаря полимеразной цепной реакции. В этом случае процесс копирования является управляемым и позволяет удвоить даже короткие участки нуклеиновой кислоты.
После завершения каждого цикла копирования, количество фрагментов нуклеиновой кислоты возрастает в геометрической прогрессии. Именно поэтому сам процесс называют «цепной реакцией».
Спустя тридцать — сорок циклов число фрагментов достигает нескольких миллиардов.
Для амплификации in vitro (в пробирке) необходимо, чтобы в биосреде, взятой для диагностики, присутствовал специфический чужеродный фрагмент ДНК (то есть ДНК не пациента, а возбудителя). Если в созданном растворе не будет находиться специфический фрагмент – цепная реакция под действием полимеразы не пойдет. Этим и объясняется факт высокой специфичности ПЦР.
Этапы ПЦР-диагностики
6. Путём проведения электрофореза подводится итог, и подсчитываются результаты удвоения.
Полимеразная цепная реакция (ПЦР)— экспериментальный метод молекулярной биологии, который представляет собой специфическую амплификацию нуклеиновых кислот, индуцируемую синтетическими олигонуклеотидными праймерами in vitro.
Идея разработки метода ПЦР принадлежит американскому исследователю Kary Mullis, который в 1983 г. создал метод, позволивший амплифицировать ДНК в ходе циклических удвоений с помощью фермента ДНК-полимеразы в искусственных условиях. Через несколько лет после опубликования этой идеи, в 1993 г., К. Mullis получил за нее Нобелевскую премию.
В начале использования метода после каждого цикла нагревания- охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она быстро инактивировалась при высокой температуре. Процедура была очень неэффективной, требовала много времени и фермента. В 1986 г. ее существенно модифицировали за счет использования ДНК-полимеразы из термофильных бактерий. Эти ферменты способны выдерживать множество циклов реакции, что позволяет автоматизировать проведение ПЦР. Одна из наиболее часто использовавшихся термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-ДНК-полимеразой.
Суть метода.Метод основан на многократном избирательном копировании определенного участка ДНК при помощи фермента Taq- ДНК-полимеразы. Полимеразная цепная реакция позволяет получить амплификаты длиной до нескольких тысяч пар нуклеотидов. Для увеличения длины ПЦР-продукта до 20-40 тыс. пар нуклеотидов применяют смесь различных полимераз, но все равно это значительно меньше длины хромосомной ДНК эукаротической клетки.
Реакция проводится в программируемом термостате (амплификаторе) — приборе, который может проводить достаточно быстро
охлаждение и нагревание пробирок (обычно с точностью не менее 0,1 °С). Амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» и последующего хранения. Для ПЦР в режиме реального времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Обычно при проведении ПЦР выполняется 20-45 циклов, каждый из которых состоит из трех стадий: денатурации, отжига праймеров, элонгации (рис. 6.1 и 6.2). На рис. 6.1 представлена динамика изменения температуры в пробирке при проведении цикла ПЦР.
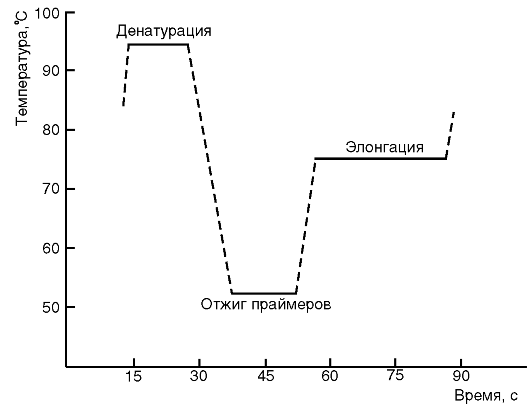 Рис. 6.1.График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Рис. 6.1.График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Денатурация ДНК-матрицыпроводится с помощью нагревания реакционной смеси до 94-96 °С на 5-90 с, чтобы цепи ДНК разошлись. Следует отметить, что перед первым циклом осуществляют предварительный прогрев реакционной смеси в течение 2-5 мин для полной денатурации исходной матрицы, что позволяет снизить количество неспецифичных продуктов реакции.
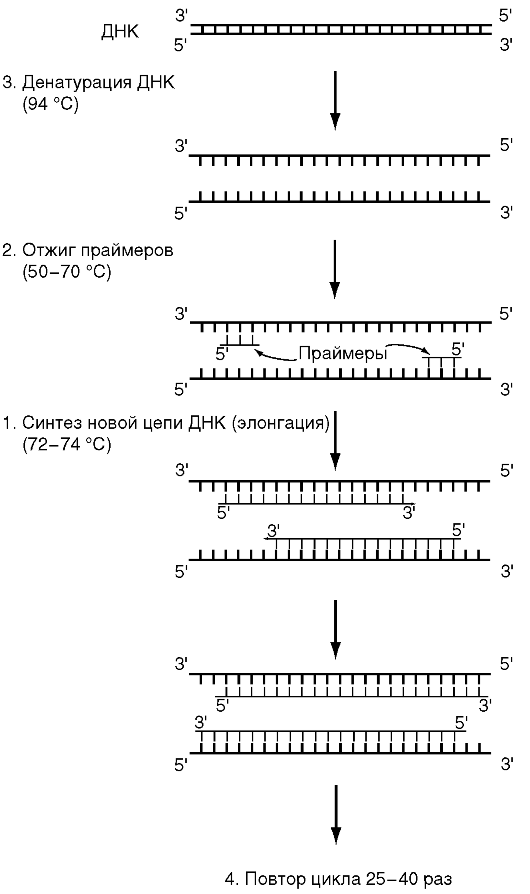 Рис. 6.2.Схема первого цикла полимеразной цепной реакции
Рис. 6.2.Схема первого цикла полимеразной цепной реакции
Стадия отжига праймеров.При плавном снижении температуры праймеры комплементарно связываются с матрицей. Температура отжига зависит от состава праймеров и обычно она на 4-5° ниже расчетной температуры плавления. Длительность стадии — 5-60 с.
Во время следующей стадии — элонгации— происходит синтез дочерней цепи ДНК на матрице материнской. Температура элонгации зависит от полимеразы. Часто используемые ДНК-полимеразы Taq и Pfu наиболее активны при 72 °С. Время элонгации, в основном зависящее от длины ПЦР-продукта, обычно составляет 1 мин на каждую тысячу пар оснований.
После проведения ПЦР проба инкубируется при температуре 72 °С в течение 10 мин. Количество специфического продукта реакции (ограниченного праймерами) при 100% эффективности теоретически возрастает в геометрической прогрессии по формуле Р = 2 n , где Р — количество специфического продукта, а η — число циклов реакции. Практически эффективность ПЦР меньше 100%, поэтому в действительности P = (1 + E) n ,где P — количество продукта; Е — средняя эффективность цикла; а n — число циклов реакции.
При большем, чем указано, количестве циклов реакции происходит накопление неспецифических продуктов последней. Рост требуемого продукта в геометрической прогрессии ограничен числом реагентов, присутствием ингибиторов и побочных продуктов реакции. На последних циклах рост замедляется, это называют «эффектом плато» (рис. 6.3). Кинетика ПЦР имеет экспоненциальный характер только на начальном этапе, после чего начинается выход на плато в силу истощений в реакции компонентов (dNTP, праймеров) и нарастающего температурного повреждения Таq-ДНК-полимеразы, конкуренции за фермент амплификонов.
Компоненты полимеразной цепной реакции.Компоненты, используемые в ПЦР, следующие: Taq-ДНК-полимераза, дезоксирибонуклеотидтрифосфаты, буферный раствор, «прямой» и «обратный» праймеры, а также ДНК-матрица.
Фермент Taq-ДНК-полимераза. При оптимальных условиях в реакционной смеси ПЦР (50-100 мкл) фермент содержится в количестве 0,5-2 единиц на пробу. Taq-ДНК-полимераза синтезирует цепь ДНК до 1000 пар оснований в минуту. Увеличивая время полимеризации и подбирая новые разновидности ДНК-полимеразы, обладающие и экзонуклеазной (редактирующей) активностью, вырезающей ошибочные (некомплементарные) нуклеотиды, удалось получить очень
длинные амплифицированные ДНК — до 42 тыс. пар оснований (Лонг-ПЦР). Избыток Таq-ДНК-полимеразы увеличивает образование неспецифических продуктов ПЦР.
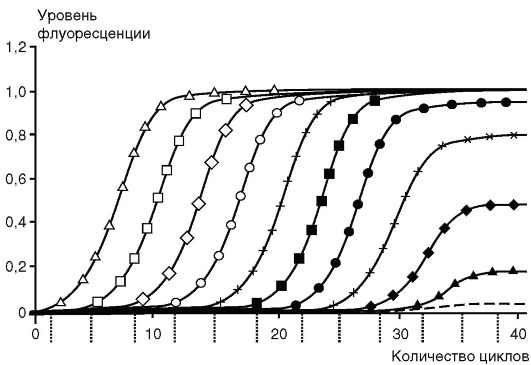 Рис. 6.3.Динамика накопления продукта при полимеразной цепной реакции
Рис. 6.3.Динамика накопления продукта при полимеразной цепной реакции
dNTP. Дезоксирибонуклеотидтрифосфаты (dNTP), используемые в ПЦР, следующие: dATP, dGTP, gTTP, dCTP. dNTP содержатся в реакционной смеси в эквивалентных концентрациях от 200 до 500 мкм, так как избыток какого-либо из них увеличивает ложное спаривание нуклеотидов в ПЦР.
Праймеры. Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, каждый из последних комплементарен одной из цепей двухцепочечной матрицы, обрамляет начало и конец амплифицируемого участка (рис. 6.4).
Поскольку праймеры каждый раз встраиваются в амплифицируемые фрагменты ДНК-матрицы (амплификоны), то они должны в реакционной смеси ПЦР присутствовать в избытке, и концентрация их составляет 0,5-1 мкМ. Специфичность получаемого продукта
ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплементарными участками ДНК-матрицы, образуя двухцепочечные структуры.
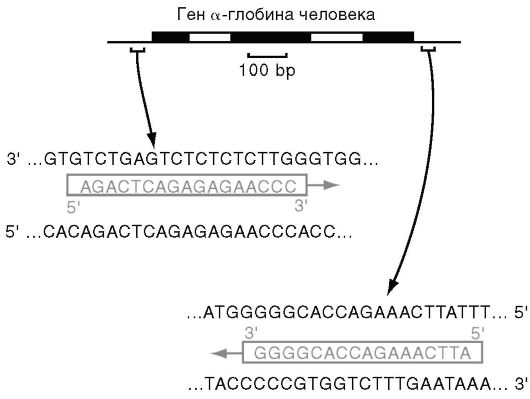 Рис. 6.4.Пример «прямого» и «обратного» праймеров
Рис. 6.4.Пример «прямого» и «обратного» праймеров
Буферная система. 10-кратный буфер для ПЦР чаще всего имеет состав: 0,5 М KCl; 0,2 М Трис-HCl, pH 8,4; 25 мМ MgCl2; 1 мг/мл бычьего сывороточного альбумина (БСА) — пример стандартной прописи буферной системы.
Tris Cl.Высокое значение рН нужно из-за того, что при повышении температуры рН Tris-буфера падает и при 72 °С составляет
KCl.Средние концентрации KCl стимулируют на 40-60% активность Taq-ДНК-полимеразы (но 0,2 M полностью ингибирует полимеразную активность).
MgCl2.Диапазон рабочих концентраций: 0,5-5 мМ. Увеличение концентрации Mg 2+ оказывает очень резкое влияние на специфичность и эффективность ПЦР: увеличивается выход, но более высокими темпами уменьшается специфичность. Оптимум зависит от последовательностей матрицы и праймеров.
Таким образом, слишком низкая концентрация Mg 2+ — низкий выход, слишком высокая — неспецифическая амплификация.
На молекулярном уровне: Mg 2+ образует комплексы с dNTP’s. Именно эти комплексы являются субстратом для Taq-ДНК- полимеразы. C Mg 2 + стехиометрически связываются dNTP’s, PPi, EDTA, PO4. Повышение концентрации Mg 2+ вызывает повышение температуры плавления ДНК.
В полимеразной цепной реакции используется вода высокой очистки (MQ). В зависимости от конструкции прибора (если «крышка» амплификатора не нагревается) в реакцию бывает необходимым на ПЦР-смесь наслаивать стерильное минеральное масло для предотвращения испарения пробы.
ДНК-матрица. Общее количество ДНК, вносимой в пробирку для ПЦР, не должно превышать 1 мкг, ибо большой избыток неспецифической ДНК снижает специфичность и чувствительность ПЦРамплификации ДНК-матрицы. Подготовка пробы материала (выделение ДНК или РНК) должна проводиться в условиях, исключающих перекрестное загрязнение исследуемых проб выделяемыми нуклеиновыми кислотами.
Чтобы ПЦР прошла успешно, должна произойти гибридизация праймеров с нужной последовательностью-мишенью. Если эта последовательность слегка различается у разных индивидуумов или у микроорганизмов из разных изолятов (т.е. имеет место полиморфизм), может произойти ее неполное спаривание с амплимером и нарушение нормальной амплификации, что приведет к получению ложноотрицательного результата. Следует отметить: у человека большая часть геномных последовательностей консервативна и не различается у разных индивидуумов, а потому обычно в таких случаях для работы подходят одинаковые наборы «консервативных» праймеров.
Контаминация.Для исключения ложноположительного результата необходимо обязательное использование чистых перчаток, одноразовых пробирок и наконечников к автоматическим пипеткам, проведение предварительной ультрафиолетовой обработки помещения и рабочих поверхностей столов и приборов. Подчеркнем: ДНКматрицы генов клеток, вирусов и бактерий пригодны для ПЦР в течение десятков лет даже после замораживания, высушивания, температурной или химической денатурации белков и др.
Чувствительность ПЦР порой достигает математически возможного предела (детекции 1 копии ДНК-матрицы), поэтому существует высокая степень опасности получения ложноположительного результата в силу переноса через предметы и реагенты как самой ДНКматрицы (реже), так и амплификонов (очень часто), получаемых в больших количествах во многих пробирках в течение ежедневной работы.
Причинами ложноположительных результатов являются следующие 3 вида контаминаций.
1. Контаминация от пробы к пробе (в процессе обработки клинических образцов или при раскапывании реакционной смеси), приводящая к появлению спорадических ложноположительных результатов.
2. Контаминация рекомбинантными плазмидами, содержащими клонированные последовательности детектируемого гена.
3. Контаминация продуктами амплификации (амплификонами). Она — наиболее частая причина ложноположительных результатов, поскольку в процессе ПЦР-генодиагностики амплификоны накапливаются в больших количествах и очень легко переносятся с аэрозолями и через приборы. Поэтому детекция продуктов ПЦР должна проводиться в изолированной комнате сотрудником, не производящим обработку клинических образцов и не готовящим реактивы для ПЦР. Приготовление основных растворов также должно производиться в отдельной чистой комнате. Все растворы следует хранить и использовать небольшими порциями.
Необходимо постоянно осуществлять собственные виды лабораторного контроля и периодически применять зашифрованные отрицательные и положительные контрольные образцы для оценки специфичности и чувствительности ПЦР-генодиагностических исследований. Неуклонно выполняя эти требования и выполняя в каждой ПЦР отрицательный контроль разных типов (на процедуру обратной транскрипции, буферный раствор, праймеры), можно практически исключить ложноположительные результаты ПЦР.
Очень важен для правильной интерпретации результатов выбор способов контроля. Положительный и отрицательный контроль должен быть хорошо охарактеризован. Часто используют ДНК из клеточных линий, заведомо содержащих или не содержащих последовательность-мишень. В каждом анализе нужны как минимум три вида контроля:
1) положительный контроль (образец заведомо содержит последовательность-мишень);
2) отрицательный контроль (образец заведомо не содержит последовательность-мишень);
3) бланк-контроль (реакционная смесь, в которой присутствуют все компоненты за исключением ДНК; бланк-контроль является индикатором загрязнений).
Один тип положительного контроля должен содержать максимальное число последовательностей-мишеней, другой — небольшое их число. Это позволяет определить чувствительность и эффективность ПЦР.
Детекция.Для анализа ПЦР-амплифицированной ДНК существуют разные методы: гель-электрофорез, дот-блот-гибридизацию и блот-гибридизацию по Саузерну. С их помощью можно анализировать большинство ПЦР-продуктов, но абсолютно точные результаты получают только при секвенировании. Следует отметить: в дальнейших главах будет описана модификация ПЦР — полимеразная цепная реакция в режиме реального времени, в которой детекция возрастания количества ПЦР-продуктов осуществляется непосредственно в пробирке при прохождении реакции (см. ниже).
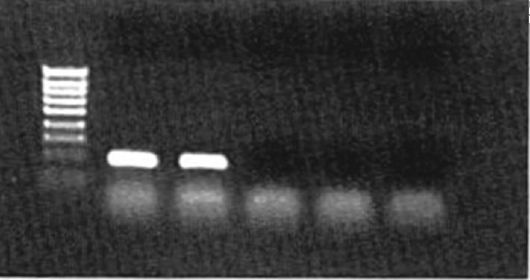 Рис. 6.5.Фотография электрофоретического геля с ПЦР-продуктами
Рис. 6.5.Фотография электрофоретического геля с ПЦР-продуктами
Присутствие специфического ПЦР-продукта (амплификона) в подавляющем большинстве случаев детектируют электрофоретическим разделением ПЦР-амплификационной смеси на окрашенных бромистым этидием агарозном или полиакриламидном гелях. Для такого выявления необходимо не менее 20 нг ДНК. Специфичность полосы амплифицированной ДНК подтверждается ее положением (размерами) по отношению к маркерным фрагментам и ДНКстандарту. Дополнительные доказательства специфичности амплификона получают путем расщепления специфическими рестриктазными
ферментами или путем гибридизации со специфическим радиоактивным или флуоресцентным олигонуклеотидным зондом.
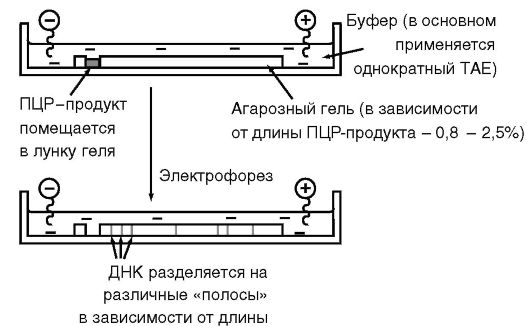 Рис. 6.6.Устройство горизонтальной электрофоретической камеры
Рис. 6.6.Устройство горизонтальной электрофоретической камеры
Электрофорез в агарозном геле позволяет легко, без применения радиоизотопов, обнаружить амплифицированную ДНК и определить ее размер (рис. 6.5 и 6.6). Остановимся на некоторых ее особенностях применительно к анализу ПЦР-амплифицированной ДНК:
а) 10-20 мкл амплифицированной ДНК разделяют в 2% агарозном геле вместе со стандартными фрагментами размером 50-1000 пар нуклеотидов;
б) электрофорез проводят при высоком напряжении (10-15 В/см), поскольку образующиеся при ПЦР небольшие фрагменты сложно детектировать после электрофореза в течение ночи при небольшом напряжении вследствие их интенсивной диффузии.
Разрешение можно повысить, используя полиакриламидные или агарозные гели с высокой концентрацией агарозы (3-4%). Впрочем, если анализ нужно провести быстро и с небольшими затратами, вполне приемлемы 2% агарозные гели. Обычно при амплификации ДНК, выделенной из фиксированных тканей, выход ПЦР-продуктов ниже, и они менее специфичны, чем в случае амплификации высокоочищенной ДНК.
Метод гибридизации ПЦР-амплифицированной ДНК (по Саузер- ну) позволяет идентифицировать полосы в геле, наблюдаемые после электрофореза амплифицированной ДНК. Для гибридизации используются как изотопно, так и неизотопно меченые зонды.
Дот-блот-гибридизация дает простой ответ по типу «да-нет» и особенно полезна в тех случаях, когда проводится анализ большого числа образцов.
Прямое секвенирование амплифицированной ДНК — также высоконадежный метод доказательства ее специфичности, но применяется в основном для определения точечных мутаций генов. В последние годы для детекции и одновременно количественной оценки амплифицированной ДНК все больше начинают применять гибридизационно-ферментный метод на микропланшетах. Но существуют и другие варианты: используются олигонуклеотидный зонд, его метят дигоксигенином или флуоресцеином с последующим проявлением моноклональными антителами к дигоксигенину или флуоресцеину; меченные ферментами моноклональные антитела к двухцепочечной ДНК; зонд, меченный рутением (электрохемилюминесцентный метод). Весьма перспективна для количественных детекций амплификонов на гель-электрофореграммах миниатюрная видеокамера, передающая на экран монитора интенсивность флуоресценции полос ДНК-амплификонов, что позволяет одновременно получить соотношение полос ДНК-стандарта и ДНК-амплификонов исследуемого гена.
Результат ПЦР можно квалифицировать как положительный или отрицательный в зависимости от того, обнаружена в образце интересующая вас последовательность-мишень или нет. Однако нарушение нормального хода амплификации, недостаточная чувствительность метода и непредвиденный полиморфизм последовательности-мишени в области связывания праймеров или гибридизационного зонда порой обусловливают ложноотрицательный результат. При загрязнении образцов и случайной гомологии между зондом, праймерами и последовательностью, сходной с мишенью, получаются ложноположительные результаты.
Модификации.В последние годы широко используется такой простой прием, как «горячий старт ПЦР», который заключается в предварительном прогревании пробирок с ПЦР-амплификационной смесью при температуре 95 °С в течение 3-5 мин. Такой прием предупреждает амплификацию неспецифических ДНК-фрагментов
вследствие низкотемпературного, неспецифического спаривания праймеров.
При использовании РНК в качестве матриц для ПЦР предварительно на этой РНК-матрице посредством фермента РНК-зависимой ДНК-полимеразы (обратная транскриптаза, ревертаза) синтезируют комплементарную ДНК (кДНК), затем использующуюся в качестве матрицы в ПЦР. ПЦР с обратной транскриптазой (ОТ-ПЦР) широко применяется для детекции РНК вирусов, определения экспрессии вирусных, бактериальных и клеточных генов по их РНК.
Существуют различные модификации ПЦР, использующиеся в зависимости от конкретных целей проведения реакции или от характера последующего молекулярного анализа амплификатов. Так, для трудноамплифицируемых участков ДНК (содержащих различные повторяющиеся последовательности или необычные структурные элементы), а также в тех случаях, когда матричная ДНК присутствует в следовых количествах, ПЦР проводят в два этапа, используя в качестве матричной ДНК на втором этапе амплификации продукты ПЦР, синтезированные на первом этапе. Часто в этих случаях для повышения специфичности посадки праймеров применяют систему так называемых вмонтированных праймеров, т. е. при доамплификации в качестве праймеров выбирают последовательности, локализованные внутри амплифицированного на первом этапе участка ДНК.
В ряде случаев удобно проводить мультиплексную ПЦР, т.е. одновременную амплификацию нескольких участков матричной ДНК. Можно получать меченые продукты ПЦР, добавляя в реакционную смесь меченые dNTP. Особого внимания заслуживает возможность проведения ПЦР с молекулами кДНК. На основе этой реакции разработаны методы анализа экспрессии генов и получения больших количеств кДНК. Реакция амплификации осуществима не только в растворах, но и непосредственно на хромосомных препаратах, при этом в случае использования меченых нуклеотидов продукты амплификации гибридизуются и выявляют комплементарные им участки ДНК на хромосомах. До настоящего времени доступными амплификации были участки ДНК, не превышающие по длине 5 тыс. пар оснований. В последнее время благодаря внесению ряда кардинальных усовершенствований (особый подбор праймеров, использование сразу двух различных ДНК-полимераз, специального температурного режима полимеразных циклов) возможно про-
ведение амплификации фрагментов ДНК, достигающих 35 тыс. пар оснований.
Не нашли то, что искали? Воспользуйтесь поиском:
Полимеразная цепная реакция (ПЦР) — это метод молекулярной биологии, который позволяет обнаружить в биологическом материале малые количества дезоксирибонуклеиновой кислоты (ДНК), точнее, определенных ее фрагментов, и размножить их во много раз. Затем их идентифицируют визуально путем электрофореза в геле. Реакция была разработана в 1983 г. К. Муллисом и включена в список выдающихся открытий последних лет.
Вся методика базируется на способности нуклеиновых кислот к самостоятельной репликации, что в данном случае проводится искусственно в условиях лаборатории. Воспроизведение ДНК может начаться не в любой области молекулы, а только в участках с определенной последовательностью нуклеотидов — стартовых фрагментах. Для того чтобы полимеразная цепная реакция началась, нужны праймеры (или ДНК-зонды). Это короткие фрагменты цепочки ДНК с заданной нуклеотидной последовательностью. Они комплементарные (то есть соответствующие) стартовым участкам ДНК образца.

Разумеется, чтобы создать праймеры, ученые должны изучить последовательность нуклеотидов той нуклеиновой кислоты, которая участвует в методике. Именно эти ДНК-зонды обеспечивают специфичность реакции и ее инициацию. Полимеразная цепная реакция не пойдет, если в образце не найдется хотя бы одна молекула искомой ДНК. В целом, для проведения реакции необходимы вышеуказанные праймеры, набор нуклеотидов, термоустойчивая ДНК-полимераза. Последняя является ферментом — катализатором реакции синтеза новых молекул нуклеиновой кислоты на основе образца. Все эти вещества, включая биологический материал, в котором необходимо выявить ДНК, объединяются в реакционную смесь (раствор). Она помещается в специальный термостат, выполняющий ее очень быстрое нагревание и охлаждение за заданное время — цикл. Обычно их 30-50.
Как проходит эта реакция
Сущность ее в том, что во время одного цикла праймеры присоединяются к нужным участкам ДНК, после чего идет ее удвоение под действием фермента. На основе получившихся нитей ДНК в последующих циклах синтезируются новые и новые идентичные фрагменты молекулы.
Полимеразно-цепная реакция идет последовательно, выделяют следующие ее стадии. Первая характеризуется удваиванием количества продукта в течение каждого цикла нагревания и охлаждения. На второй стадии происходит замедление реакции, поскольку фермент повреждается, а также теряет активность. Помимо этого, истощаются запасы нуклеотидов и праймеров. На последней стадии — плато — продукты более не накапливаются, поскольку реактивы закончились.
Где ее применяют
Несомненно, широчайшее применение полимеразная цепная реакция находит в медицине и науке. Ее используют в общей и частной биологии, ветеринарной медицине, фармации и даже экологии. Притом в последней это делают для отслеживания качества продуктов питания и объектов внешней среды. Активно применяется полимеразная цепная реакция в криминалистической практике для подтверждения отцовства и идентификации личности человека. В судебно-медицинской экспертизе, так же, как и в палеонтологии, часто эта методика является единственным выходом, так как обычно для исследования доступно крайне малое количество ДНК. Безусловно, очень широкое применение метод нашел в практической медицине. Он необходим в таких ее областях, как генетика, инфекционные и онкологические заболевания.
